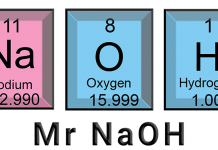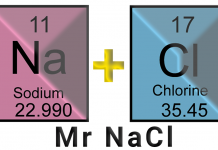Kali ini kita akan belajar lebih jauh tentang molalitas dan contoh soal molalitas serta mengetahui cara menjawab soal soal molalitas.
Kalian masih ingat tentang konsep molaritas bukan, kalau belum ingat silahkan baca artikel ini Pengertian dan Rumus Molaritas dan Contoh Soal Molaritas (Lengkap).
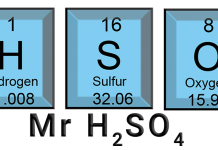
Mol adalah gram (g) zat dibagi dengan massa molekul relatif (Mr). Rumus menghitung mol suatu senyawa adalah sebagai berikut:
Pengertian Molalitas
Apa itu molalitas. Seperti yang mungkin kalian sudah ketahui, molalitas adalah kemolalan atau konsentrasi molal (m) yang menyatakan jumlah mol zat terlarut dalam 1000 gram pelarut.
Tentu kalo kalian ingat pengertian molaritas, yaitu jumlah mol zat terlarut dalam setiap satu liter larutan, artinya berbeda. Molalitas menggunakan ukuran gram pelarut sedangkan molaritas menggunakan ukuran volume pelarut.
Artinya perbedaan molaritas dan molalitas adalah pada ukuran pelarutnya yaitu molaritas menggunakan volume, dan molalitas menggunakan gram. Perbedaan molalitas dan molaritas akan lebih jauh dijelaskan pada artikel ini
Perbedaan Molaritas dan Molalitas
Rumus Molalitas
Rumus molalitas sebenarnya cuman satu yaitu:
\[{\rm{m = }}\frac{{\rm{n}}}{{\rm{P}}}\]
- m=Molalitas (m)
- n= jumlah mol zat
- P= massa zat dalam kg.
Rumus molalitas diatas dapat dibentuk menjadi rumus molalitas lain yang dapat digunakan untuk menjawab soal molalitas yang massanya dalam bentuk gram (bukan kg).
Rumus kedua dibawah apabila n (mol) zat sudah diketahui
\[{\rm{m = }}\frac{{\rm{g}}}{{M_r^{}}}{\rm{x}}\frac{{{\rm{1000}}}}{{\rm{P}}}\]
- m= molalitas
- n= Mol zat
- P= massa pelarut dalam satuan gram
Dan rumus ketiga dibawah bila n (mol) zat masih mau dicari.
$$n = {g \over {M_r^{}}}$$
- m = molalitas
- g = massa zat terlarut
- Mr = Massa molekul relatif
- P=massa pelarut dalam bentuk gram
Untuk lebih jelasnya mari kita lihat contoh soal molalitas dibawah ini
Contoh Soal Molalitas dan Jawabannya
Bagi kalian yang betul mau serius belajar ada bagusnya kalo kalian kerja dulu soalnya baru
Soal Molalitas Pertama
Seorang siswa melarutkan 10 gram natrium hidroksida (NaOH) dalam 2 kg air. Massa molekul relatif (Mr) NaOH adalah 40. Hitunglah Molalitas (m) larutan tersebut ?.
Pembahasan Soal
Diketahui
- Massa zat (g) NaOH = 10 gram
- Massa zat pelarut (P) = 2 kg
- Mr NaOH = 40
- m = …. ?
Jawaban soal:
Kita gunakan rumus Pertama molalitas yang langsung yaitu
\[{\rm{m = }}\frac{{\rm{n}}}{{\rm{P}}}\]
- m=Molalitas (m)
- n= jumlah mol zat
- P= massa zat dalam kg.
Jadi kita cari dulu jumlah mol zat, jadi kita gunakan rumus
\[\begin{array}{l}
n = \frac{g}{{M_r^{}}}\\
n = \frac{{10}}{{40}}\\
{\rm{n = 0}}{\rm{,25 mol}}
\end{array}\]
Kita langsung gunakan rumus diatas
\[\begin{array}{l}
{\rm{m = }}\frac{{\rm{n}}}{{\rm{P}}}\\
{\rm{m = }}\frac{{{\rm{0}}{\rm{,25}}}}{{\rm{2}}}{\rm{ = 0}}{\rm{,125 m}}
\end{array}\]
Jadi molalitas larutan NaOH diatas adalah 0,125 m
Soal Molalitas Kedua
Apabila 17,1 gram larutan gula tebu (Mr= 342) dimasukkan kedalam 500 gram air. Berapa molalitas larutan tersebut?
Pembahasan SoalDiketahui:
massa zat (g) = 17,1 gram
Mr zat = 342 gram/mol
Massa pelarut (P) = 500 gram
Dit : m = ….. ?
Jawaban
Kita gunakan rumus kedua yang langsung mencari molalitas menggunakan massa air yang gram.
\[\begin{array}{l}
{\rm{m = }}\frac{{\rm{g}}}{{M_r^{}}}{\rm{x}}\frac{{{\rm{1000}}}}{{\rm{P}}}\\
{\rm{m = }}\frac{{17,1}}{{342}}{\rm{x}}\frac{{{\rm{1000}}}}{{500}}\\
{\rm{m = 0}}{\rm{,05 x 2}}\\
{\rm{m = 0}}{\rm{,1 m}}
\end{array}\]
Jadi molalitas larutan gula tebu diatas setelah ditambahkan kedalam 500 gram air adalah 0,1 molal.
Soal Molalitas Ketiga
Kali ini ada kita tidak mencari molalitas zat, tapi mencari massa pelarut yang digunakan.
Zat dengan massa 60 gram (1 molal) memiliki Mr = 60. Hitulanglah massa pelarut yang digunakan?
Diketahui
- massa zat (g) =60 gram
- Mr zat (Mr) = 60
- molal zat (m) = 1
- Dit : … P ?
Jawaban
Kita gunakan rumus molalitas yang pertama yaitu
\[{\rm{m = }}\frac{{\rm{n}}}{{\rm{P}}}\]
- m=Molalitas (m)
- n= jumlah mol zat
- P= massa zat dalam kg.
Maka kita cari dulu n atau molar zat tersebut
\[\begin{array}{l}
n = \frac{g}{{M_r^{}}}\\
n = \frac{{60}}{{60}}\\
{\rm{n = 1 mol}}
\end{array}\]
Maka, massa pelarut zat tersebut diatas adalah
\[\begin{array}{l}
{\rm{m = }}\frac{{\rm{n}}}{{\rm{P}}}\\
{\rm{1 = }}\frac{{\rm{1}}}{{\rm{P}}}\\
{\rm{P = 1 kg}}
\end{array}\]
Jadi massa zat pelarut yang digunakan adalah 1 kg atau 1000 gram

Molaritas dan Contoh Soal Molaritas
Soal Molalitas Keempat
Soal berikut kita akan mencari molalitas larutan HCl dengan menggunakan persen massa
Berapakah molalitas larutan HCL 40 % (massa) ?
Diketahui
Mr HCl = Ar H + Ar Cl
Mr HCl = 1 + 35
Mr HCl = 36
Jawaban
Dari soal diatas, kita tahu bahwa larutan tersebut tersusun atas 40 % HCl dan 60 % pelarut. Maka kita bisa ambil permisalan massa keseluruhan larutan itu 100 gram.
Maka,
Massa HCl = 40 % x 100 gram = 40 gram
Massa pelarut = 60 % x 100 gram = 60 gram
karena kita sudah tahu massa keduanya, dan Mr juga sudah ketahui, kita tinggal cari molalitas menggunakan rumus molalitas yang kedua
\[\begin{array}{l}
{\rm{m = }}\frac{{\rm{g}}}{{M_r^{}}}{\rm{x}}\frac{{{\rm{1000}}}}{{\rm{P}}}\\
{\rm{m = }}\frac{{{\rm{40}}}}{{{\rm{36}}}}{\rm{x}}\frac{{{\rm{1000}}}}{{{\rm{60}}}}\\
{\rm{m = 1}}{\rm{,1 x 16}}{\rm{,7}}\\
{\rm{m = 18}}{\rm{,7 molal}}
\end{array}\]
Jadi molalitas larutan HCl diatas adalah 18,7 molal.
Soal Molalitas Kelima
Soal kali ini akan menjawab massa zat yang akan dilarutkan untuk mencapai molal tertentu
Tentukan banyaknya (gram) NaOH yang harus dilarutkan kedalam 2 liter air (p air = 1,00 g/mL) agar diperolah NaOH 0,25 m.
Diketahui:
- Mr NaOH = 40
- Molal (m) = 0,25 molal
- Volume pelarut (air) = 2 liter = 2000 mL
- Massa jenis air (p) = 1,00 g/mL
Jawaban
Dari soal diatas, kita belum ketahui massa pelarut atau massa air maka kita hitung dulu massa air dengan menggunakan volume air dan massa jenis air
massa air (P) = V x p = 2000 mL x 1,00 g/mL = 2000 gram
karena kita sudah tahu P atau massa pelarutnya, kita tinggal cari molalitas menggunakan rumus kedua
\[\begin{array}{l}
{\rm{m = }}\frac{{\rm{g}}}{{M_r^{}}}{\rm{x}}\frac{{{\rm{1000}}}}{{\rm{P}}}\\
{\rm{0}}{\rm{,25 = }}\frac{g}{{40}}{\rm{x}}\frac{{{\rm{1000}}}}{{2000}}\\
{\rm{0}}{\rm{,25 = }}\frac{g}{{40}}{\rm{x0}}{\rm{,5}}\\
{\rm{0}}{\rm{,25 x 40 = g x 0}}{\rm{,5}}\\
{\rm{g = }}\frac{{{\rm{0}}{\rm{,25×40}}}}{{{\rm{0}}{\rm{,5}}}}\\
{\rm{g = }}\frac{{10}}{{0,5}}\\
g = 20
\end{array}\]
Jadi, massa NaOH yang dibutuhkan adalah 20 gram NaOH.
Demikianlah artikel tentang Pengertian molalitas, dan contoh soal molalitas dan cara menghitung molalitas dan rumus rumus molalitas. Sekian dan tetap belajar,karena belajar itu mudah. Bagi yang punya pertanyaan sekitar molalitas atau punya soal molalitas yang ingin dibantu jawab silahkan pasang komentar dibawah ini.